CN被称为氰化物,是一种假卤化物阴离子。它属于氰基,由碳原子和一个有三键的氮原子组成。它带-1电荷,是氰化氢(HCN)的共轭碱。
氰化物在自然界中通过生氰化合物释放,也由几种微生物产生。我们可以在有机分子如乙腈和无机分子如氰化钾中找到CN-离子。
含有CN离子的化合物在当今世界有着广泛的应用。它可以作为还原剂。
作为HCN,我们发现用于毒气室处决和制备农药和杀虫剂。
作为NCN,它被用于金和银的开采。除此之外,氰化物还可用于食品添加剂和珠宝制造行业。
然而,氰化物盐对人体有毒。与水发生反应也会产生烟雾和火灾。它会引起哮喘、支气管炎、酸中毒、产前损伤,甚至脑水肿。
现在让我们讨论氰化物离子内部的化学键,以更好地理解它的化学和物理性质。
路易斯结构
什么是路易斯结构?

如果我们仔细看一下上面的图表,我们可以看到这是一个氧原子的草图。因为氧原子的原子序数是8,所以最外层有6个电子。
最外层被称为价层,它决定了分子形成时原子与其他原子的化合能力。
刘易斯结构是一种化合物内部结构的简化和简单的图解表示。在这里,价电子用点表示,我们用直线表示价电子之间形成的键的类型。
虽然Lewis结构没有给我们很多关于成键的细节,但它是理解三维分子形状或发现杂化本质的第一步。
找出了CN离子的Lewis结构
氰化物阴离子由碳原子和氮原子组成。
碳属于元素周期表的第4或14族,因此有4个价电子。
氮属于5/15族,价为5。
此外,我们还需要考虑给CN-离子提供负电荷的电子。价电子总数= 4 + 5 + 1 = 10。
因为CN是双原子离子,所以这里没有中心原子的概念。
现在,我们将继续画一个简单的草图或氰化物离子的骨架图。

我们把碳原子和氮原子都放在这里作为原子符号。今后我们将使用电子点表示法。

我们把所有的10个价电子都放在了CN离子分子的组成原子周围。这就是八隅体实现的概念。
八隅体规则/八隅体实现:让我们看看元素周期表。
主要的群元素。第1组到第17组元素倾向于达到惰性气体的结构,这被称为八隅体规则。
这里有碳原子和氮原子。两者都趋向于达到氖(同时期惰性气体)的八隅体构型。
如果我们观察上面所示的刘易斯结构,我们可以看到氮(N)已经实现了八隅体实现。然而碳仍然只有四个电子环绕。

碳有6个价电子。它仍然没有实现Neon配置。

现在,碳原子和氮原子都实现了八隅体实现。
形式电荷
现在,我们要找出阴离子内部原子的形式电荷值。

对于碳,形式电荷= 4 - 0.5*6 - 2 = -1。
对于氮,形式电荷= 5 - 0.5*6 - 2 = 0。
因为这些元素都是以它们最不可能的形式电荷值出现的,所以我们得到了最适合CN的路易斯结构草图。
同时,净形式电荷值= -1。
我们已经实现了CN阴离子内部的负电荷。
这是CN阴离子的路易斯结构。
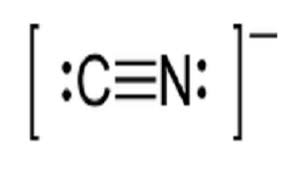
分子几何
路易斯结构给我们分子或离子结构的二维图示。
此外,它还帮助我们进入理解化学键的下一步,即预测任何分子的3D分子形状。我们将通过VSEPR理论找出分子的几何结构。
VSEPR理论
VSEPR代表价壳电子对排斥模型。
这一理论指出了这样一个事实,即电子倾向于在任何分子内部的组成原子核周围形成带负电的云大气。
因为它们像电荷,它们相互排斥,为了得到稳定的分子,这些斥力需要最小化。
这里,电子既指成键的或成对的电子(BP),也指单独的或未成键的电子对(LP)。
LP-LP > LP-BP > BP-BP(强度情况下)。
CN-分子几何
当分子结构中有两个以上的原子时,我们需要考虑VSEPR符号和空间数。
对于CN-,我们只有两个组成原子。
根据VSEPR理论,离子的三维形状或几何形状是线性的。
C和N都有对称的价电子分布来形成阴离子。而且,每个轨道上孤对的数量是相等的。线性几何因此是必要的,以减少排斥和获得稳定性。
键角是180度。

CN极性
极性是什么意思?
极性是任何化学分子的重要性质。这取决于电荷的分离。这个特性是由另一个叫做电负性的概念来定义的。
为此,我们可以参考鲍林电负性图:
这里,在鲍林电负性量表中,我们可以了解到电负性值在元素周期表中基团和周期的变化趋势。
电负性:它是一种原子性质,描述了它倾向于获得或获得更多的电子以形成键。
当相同元素的两个原子聚在一起形成均匀的双原子分子时,由于线性排列和相同的电负性值(例如Cl2),我们有一个非极性分子。这里,净偶极子为零。
然而,当两个或两个以上不同元素的原子组成一个分子,或者分子形状不对称时,我们就会发现一个净偶极子不等于0的极性分子(例如H2O)。
CN阴离子是极性的还是非极性的?
现在,让我们关注氰化物阴离子。
如果我们参考上面提供的鲍林图,我们可以找到C和N的电负性值。
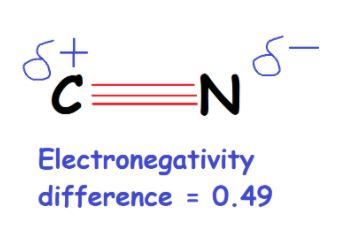
C的电负性值为2.55,N的电负性值为3.04。
因此,差值相当于0.49。
如果差值在0.4到1.7之间,我们认为这个键是极性键。同样,由于碳的正电性比氮稍强,所以碳带部分正电荷,而氮带一个负电荷。
三键作为一个轻微的极性键和离子性质的CN使它与极性溶剂,如水相互作用。
CN杂交
为了理解氰化物离子内部化学键的性质,我们已经学习了如何绘制二维刘易斯结构的图形插图。
在此之后,为了更深入地研究,我们讨论了CN-的三维分子几何结构以及键角。我们还讨论了负电性的差异和阴离子的极性。
现在是化学键中最有趣和最重要的概念之一:轨道杂交
轨道杂化
原子轨道或ao有多种形状和类型,例如s,p,d,f。
我们已经知道,轨道是数学概率函数,表示电子可以出现在任何区域的位置。
为了使杂化发生,我们需要同一原子中具有几乎相等能量的原子原子聚集在一起并融合。这就产生了杂化轨道,比如sp, sp2, sp3, sp3d等等。
例如,1s轨道和3p轨道融合形成sp3杂化。
杂化轨道具有相同的能量。
CN中的杂交
如果我们看一下CN-的路易斯结构,我们可以看到碳和氮之间已经形成了一个三键。
这表示键有1个和2个键。键是由p轨道的侧对侧重叠形成的,在杂化中没有任何作用。
空间数=分子内与中心原子结合的原子数+与中心原子结合的孤对电子数
空间数= C和N的1 sigma + 1个孤电子。
因此,我们可以把杂化解释为sp.
C和N的sp轨道结合形成了C的sigma键⦀N。
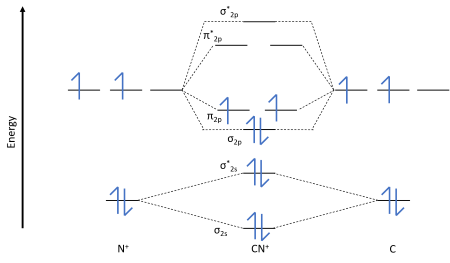
分子轨道图
分子轨道理论与VBT和轨道杂交理论略有不同。在这里,来自分子内部不同原子的ao可以聚集在一起形成分子轨道或MOs。
因此,分子内部的价电子是共享的。
C和N的电子构型如下:
碳(原子序数:6)
C: 1s2 2s2 2p2
氮(原子序数:7)
N: 1s2 2s2 2p3
在MO理论中,我们有非成键、反成键和成键轨道的概念。
1s轨道上的四个电子是非成键轨道。
The and orbitals are bonding orbitals.
*和*是反键轨道。
下面,我们可以看到CN离子的MO图。
结论
我们详细地讨论了与氰化物离子成键有关的几个重要术语和概念。
学习快乐!





这是如此有用,全面和有见地。非常感谢。